Адамның EGFR генінің 29 мутациялары
Өнім атауы
HWTS-TM0012A-Адам EGFR генінің 29 мутациясын анықтау жинағы (флуоресценциялық ПТР)
Эпидемиология
Өкпе рагы бүкіл әлемде қатерлі ісіктен болатын өлімнің негізгі себебіне айналды, бұл адам денсаулығына айтарлықтай қауіп төндіреді. Ұсақ жасушалы емес өкпе рагы өкпе рагымен ауыратын науқастардың шамамен 80%-ын құрайды. EGFR қазіргі уақытта ұсақ жасушалы емес өкпе рагын емдеудің ең маңызды молекулалық нысанасы болып табылады. EGFR фосфорлануы ісік жасушаларының өсуін, дифференциациясын, инвазиясын, метастазын, апоптозға қарсы әрекетін және ісік ангиогенезін ынталандыруы мүмкін. EGFR тирозинкиназа ингибиторлары (TKI) EGFR автофосфорлануын тежеу арқылы EGFR сигнал беру жолын бөгеп, осылайша ісік жасушаларының көбеюі мен дифференциациясын тежеп, ісік жасушаларының апоптозын ынталандырып, ісік ангиогенезін азайтып, ісікке бағытталған терапияға қол жеткізе алады. Көптеген зерттеулер EGFR-TKI терапиялық тиімділігі EGFR ген мутациясының күйімен тығыз байланысты екенін және EGFR ген мутациясымен ісік жасушаларының өсуін тежей алатынын көрсетті. EGFR гені 7-хромосоманың қысқа иығында (7p12) орналасқан, толық ұзындығы 200 Кб және 28 экзоннан тұрады. Мутацияланған аймақ негізінен 18-ден 21-ге дейінгі экзондарда орналасқан, 19-экзондағы 746-дан 753-ке дейінгі делеция мутациясы шамамен 45%-ды, ал 21-экзондағы L858R мутациясы шамамен 40%-дан 45%-ға дейінді құрайды. Ұсақ жасушалы емес өкпе обырын диагностикалау және емдеу бойынша NCCN нұсқаулықтарында EGFR-TKI енгізбес бұрын EGFR генінің мутациясын тексеру қажет екені анық көрсетілген. Бұл тест жинағы эпидермальды өсу факторы рецепторының тирозин киназа ингибиторын (EGFR-TKI) препараттарын енгізуді бағыттау және ұсақ жасушалы емес өкпе обыры бар науқастар үшін жекелендірілген медицина негізін қамтамасыз ету үшін қолданылады. Бұл жинақ тек ұсақ жасушалы емес өкпе обыры бар науқастарда EGFR геніндегі кең таралған мутацияларды анықтау үшін қолданылады. Тест нәтижелері тек клиникалық анықтама үшін берілген және пациенттерді жеке емдеудің жалғыз негізі ретінде пайдаланылмауы керек. Клиниктер пациенттің жағдайын, дәрілік препараттарға көрсетілімдерді және емдеуді ескеруі керек. Тест нәтижелерін жан-жақты бағалау үшін реакция және басқа зертханалық сынақ көрсеткіштері және басқа факторлар қолданылады.
Арна
| FAM | IC реакция буфері, L858R реакция буфері, 19del реакция буфері, T790M реакция буфері, G719X реакция буфері, 3Ins20 реакция буфері, L861Q реакция буфері, S768I реакция буфері |
Техникалық параметрлер
| Сақтау орны | Сұйықтық: ≤-18℃ Қараңғыда; Лиофилизацияланған: ≤30℃ Қараңғыда |
| Жарамдылық мерзімі | Сұйықтық: 9 ай; Лиофилизацияланған: 12 ай |
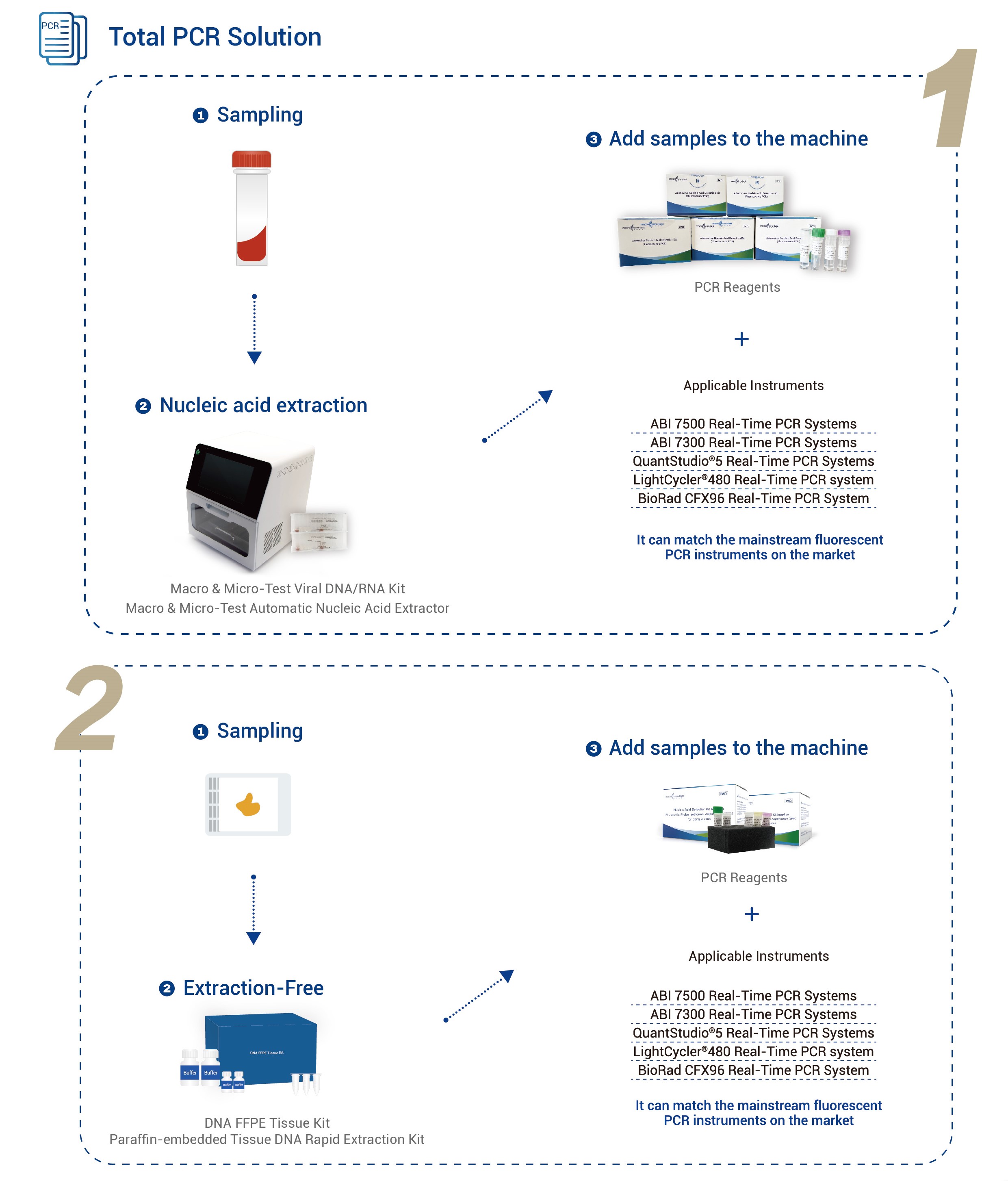
| Үлгі түрі | жаңа ісік тіндері, мұздатылған патологиялық кесінді, парафинге салынған патологиялық тін немесе кесінді, плазма немесе сарысу |
| CV | <5,0% |
| LoD | 3нг/мкл жабайы тип фонында нуклеин қышқылының реакция ерітіндісін анықтау, 1% мутация жылдамдығын тұрақты түрде анықтай алады |
| Нақтылық | Жабайы типтегі адам геномдық ДНҚ-сымен және басқа мутант түрлерімен айқаспалы реактивтілік жоқ. |
| Қолданылатын құралдар | Қолданбалы биожүйелер 7500 нақты уақыт режиміндегі ПТР жүйелеріҚолданбалы биожүйелер 7300 нақты уақыт режиміндегі ПТР жүйелері QuantStudio® 5 нақты уақыт режиміндегі ПТР жүйелері LightCycler® 480 нақты уақыт режиміндегі ПТР жүйесі BioRad CFX96 нақты уақыт режиміндегі ПТР жүйесі |